Метод флуоресцентной микроскопии полного внутреннего отражения (TIRF)
Явление внутреннего отражения световых волн наблюдается на границе раздела сред, при условии, что волна проходит из большего коэффициента преломления в среду с меньшим коэффициентом преломления. При повышении значения угла падения, он достигает некой критической точки, когда отражение становится полным. Критическое значение величины угла падения не зависит от длины волны света, на него влияют только коэффициенты преломления сред на пути луча. В той точке, где происходит падение луча, подвергающегося полному внутреннему отражению, возникает узкая область затухающих, нераспространяющихся волн, способных возбуждать флуоресценцию лишь в тонком слое материала [1]. Именно это явление лежит в основе флуоресцентной микроскопии полного внутреннего отражения (total internal reflection fluorescence, TIRF).
Толщина клетки млекопитающих, как правило, несколько микрон. Размер области нераспространяющихся волн не позволяет проникнуть на глубину более чем 100 нм. [2]. Благодаря этому метод микроскопии TIRF даёт возможность получать высококонтрастные изображения структур под мембраной клетки, непосредственно прилегающей к стеклу, где происходит полное внутреннее отражение. При этом за счёт того, что освещение очень локализовано, нет «засвечивания» изображения флуоресценцией, возбуждённой в подлежащих структурах, в частности, аутофлуоресценцией цитоплазмы, а повреждение клетки светом минимально. Короткая экспозиция, обеспечиваемая системами TIRF, позволяет наблюдать динамичные, быстро протекающие процессы [1]. TIRF отличают также низкая фототоксичность и фотообесцвечивание флуорохромов [3]. Область возбуждения не дискретна – интенсивность света в ней экспоненциально падает при удалении от области падения света. Это следует учитывать при оценке флуоресценции на разной глубине – у поверхности она будет более интенсивной, чем на краях области затухающих волн, при равном содержании флуорохрома, что требует специальной обработки изображения [1].
В качестве источника света можно использовать как лазеры, так и лампы различных типов, в зависимости от конструкции системы. Преимуществом белого света является возможность отсечь любую необходимую его составляющую с помощью фильтров и использовать для работы. [1] Каким бы не был источник света, его лучи должны освещать препарат под углом [3]. Существуют два основных способа осуществления этой задачи: освещение с использованием призм или освещение через специализированный объектив. Освещение с использованием призм требует расположения источника света над препаратом и коррекции конфигурации призм для каждого препарата. [2]Угол падения света в системах, основанных на специальных объективах, настраивается за счёт фокусировки объектива. Один из параметров объектива, который характеризует числовая апертура – возможность освещать препарат под определённым углом. Большие показатели числовой апертуры соответствуют большему углу падения. В числовом выражении, числовая апертура должна быть больше коэффициента преломления образца. Для биологических задач этому требованию вполне соответствуют объективы с числовой апертурой от 1,4. При работе с клетками с высоким показателем отражения необходимы объективы с более высоким (1,65) значением числовой апертуры и система на основе призмы. [1]. Системы на основе призм позволяют работать в более широком диапазоне длин волн, и более чувствительны, однако системы, основанные на объективах, более просты в обращении, и, не смотря на меньшие возможности в плане размера поля зрения и чувствительности, пользуются большей популярностью среди исследователей.
В общепринятом варианте граница раздела фаз, на которой происходит полное внутренне отражение, находится между покровным стеклом и образцом, однако, при решении специфических исследовательских задач, она может располагаться и глубже. Благодаря такой фокусировке в более глубоких слоях образца удалось увидеть то, что ранее считалось невозможным, например мембрану растительной клетки, скрытую под клеточной стенкой [2]. Детекцию флуоресценции в различных частях спектра можно проводить автоматически, благодаря чему TIRF можно совместить с визуализацией восстановления после фотообесцвечивания (fluorescence recovery after photobleaching, FRAP) или резонансный перенос энергии (fluorescence resonance energy transfer, FRET) [3].
TIRF широко используется в различных областях биологических исследований, прежде всего для изучения процессов и молекул, находящихся на мембране или непосредственно под мембраной клетки. Метод TIRF применим только к прикреплённым культурам. Если исследуемая клеточная культура не склонна к адгезии, следует использовать покровные стёкла покрытые коллагеном или как-то иначе стимулировать адгезию клеток, при этом нанесённое покрытие не должно влиять на оптические свойства стекла [1].
Какие именно процессы можно исследовать с помощью данного метода микроскопии, с учётом его возможностей и ограничений? На самом деле, многие задачи могут быть решены с его помощью, а многие, до его разработки, были неразрешимыми. Например, только благодаря микроскопии TIRF удалось узнать что под поверхностью мембраны лежит слой микротрубочек, связывающий микровезикулы до того момента, когда они сольются с мембраной. Также удалось отследить движение единичных везикул и экзоцитоз, который, как оказалось, протекает несколько сложнее, чем предполагалось ранее, поскольку везикулы сливаются с мембраной по нескольку раз [1]. Методом TIRF изучают процессы сигналинга на мембране, распределение сигнальных липидов, колебания концентрации циклического АМФ, активность ионных каналов, в том числе в сочетании с patch-clamp [1] [3]. Полезен метод и для изучения динамики адгезивных молекул [1]. С помощью TIRF можно охарактеризовать процессы взаимодействия вирусов с рецепторами на мембране и их проникновения в клетку, поскольку было подтверждено, что присутствие покровного стекла при TIRF не влияет на этот процесс [4].
Несмотря на то, что процесс трансфекции является широко используемым в биологии и биотехнологии, с точки зрения проникновения чужеродных молекул в клетку он не охарактеризован [4]. Более полное понимание механизмов данного процесса могло бы помочь в дальнейшем усовершенствовать методические подходы к его реализации.
Полезен метод и для разработки и исследования фармацевтических препаратов. С помощью TIRF не описать фармакокинетику препарата, его воздействие на ткань, однако можно получить ценную информацию о его взаимодействии с конечной целью – клеткой [4]. Метод может применяться для исследования воздействия различных веществ-потенциальных компонентов лекарственных препаратов на мембранные рецепторы [5].
- Mattheyses AL, Simon SM, Rappoport JZ. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J Cell Sci. – 2010. – N.123, Pt. 21. – P. 3621-8.
- Martin-Fernandez ML, Tynan CJ, Webb SE. A 'pocket guide' to total internal reflection fluorescence. J Microsc. – 2013. – N. 252. V.1. – P.16-22.
- Smyth JW, Shaw RM. Visualizing ion channel dynamics at the plasma membrane. Heart Rhythm. – 2008. – P.7-11.
- Ruthardt N, Lamb DC, Bräuchle C. Single-particle tracking as a quantitative microscopy-based approach to unravel cell entry mechanisms of viruses and pharmaceutical nanoparticles. Mol Ther. – 2011. – N.19, V.7. – P.1199-211.
- Chen M, Zaytseva NV, Wu Q, Li M, Fang Y. Microplate-compatible total internal reflection fluorescence microscopy for receptor pharmacology. Appl Phys Lett. – 2013. N.102, V.19.
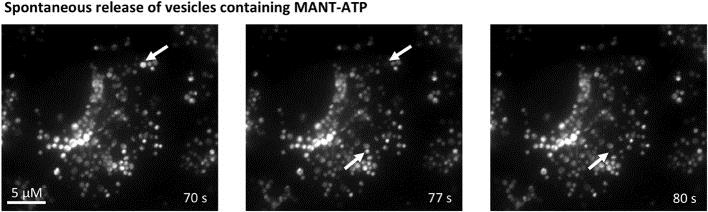
Динамика везикул под мембраной клеток почки. Стрелкой указана везикула, содержимое которой выводится из клетки. Bjaelde RG, Arnadottir SS, Overgaard MT, Leipziger J, Praetorius HA. Renal epithelial cells can release ATP by vesicular fusion. Front Physiol. 2013 Sep 19;4:238

Накопление FBP17 , участвующего в полимеризации актина, при подавлении его антогониста PSTPIP2 путём РНК-интерференции. Tsujita K, Kondo A, Kurisu S, Hasegawa J, Itoh T, Takenawa T. Antagonistic regulation of F-BAR protein assemblies controls actin polymerization during podosome formation. J Cell Sci. 2013 May 15;126(Pt 10):2267-78.
Полезные ссылки:

