FLIM — Becker&Hickl (TCSPC)
Компания Becker&Hickl предложила новый принцип регистрации единичных фотонов - принцип, который сделал метод коррелированного по времени счета фотонов (TCSPC – time correlated single photon counting) более чем в 100 раз быстрее, чем существующие на то время приборы. Был разработан многоканальный вариант TCSPC метода, который позволяет регистрировать фотоны не только в зависимости от времени, но и от других параметров, таких как длина волны излучения и пространственные координаты.
Системы счета фотонов TCSPC предназначены для записи многомерного распределения фотонов и флуоресцентных изображений с высоким временным разрешением. Помимо электронных плат счета единичных фотонов компания Becker&Hickl производит пикосекундные диодные лазеры, сверхбыстрые и чувствительные детекторы, многоканальные детекторные узлы для регистрации сигналов в широком спектральном диапазоне и программные модули для управления экспериментом, в котором требуется регистрация единичных фотонов:
- GaAsP гибридные детекторы одиночных фотонов от ультрафиолетового до инфракрасного диапазона спектра
- мультиспектральные детекторы одиночных фотонов до 16 каналов
- импульсные пикосекудные диодные лазеры: 375 нм, 405 нм, 445 нм, 473 нм, 488 нм, 515 нм, 560 нм, 590 нм, 640 нм, 785 нм, 840 нм
TCSPC - Что такое коррелированный по времени подсчет одиночных фотонов?
Подсчет одиночных фотонов с корреляцией по времени (TCSPC) является хорошо зарекомендовавшим себя и распространенным методом измерения времени жизни флуоресценции. Он также становится все более важным для измерений миграции фотонов, измерений оптической рефлектометрии во временной области и измерений времени пролета.
Принцип TCSPC заключается в обнаружении одиночных фотонов и измерении времени их прихода по отношению к эталонному сигналу, обычно источнику света. TCSPC - это статистический метод, требующий источника света с высокой повторяемостью для накопления достаточного количества фотонных событий для требуемой точности статистических данных.
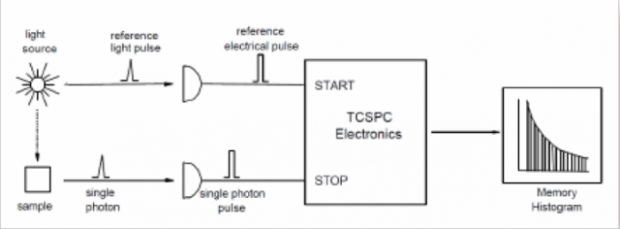
Электронику TCSPC можно сравнить с быстрым секундомером с двумя входами (рис. 1). Часы запускаются импульсом сигнала СТАРТ и останавливаются импульсом сигнала СТОП. Время, измеренное для одной последовательности СТАРТ-СТОП, будет представлено увеличением значения памяти на гистограмме, в которой каналы на оси x представляют время. С источником света с высокой частотой повторения миллионы последовательностей СТАРТ-СТОП могут быть измерены за короткое время. Результирующая гистограмма отсчетов в зависимости от каналов будет представлять интенсивность флуоресценции в зависимости от времени.
Как правило, одним из входных сигналов электроники TCSPC (либо СТАРТ, либо СТОП) будет импульс, генерируемый одним фотоном. Одиночные фотоны могут быть обнаружены фотодетекторами с высоким коэффициентом усиления. Большинство этих фотодетекторов представляют собой фотоумножители или фотоумножители с микроканальными пластинами, а также однофотонные лавинные фотодиоды. По статистическим причинам важно обеспечить детектирование не более одного одиночного фотонного события за световую вспышку. Многофотонные события повлияют на статистику гистограммы и приведут к ошибочным результатам измерений. (Это известно в литературе как «проблема наложения импульсов».) Чтобы гарантировать, что регистрируется только один фотон на световую вспышку, скорость фотонов поддерживается низкой по сравнению со скоростью возбуждающей лампы; обычно 5% или ниже.
Электроника TCSPC
Основными компонентами для обработки сигналов в TCSPC являются дискриминаторы с постоянной долей (CFD), электрические задержки (DEL), преобразователь времени в амплитуду (TAC), усилитель (между TAC и ADC), аналого-цифровой преобразователь (ADC) и цифровая память (Mem) (показана на рис. 2).
Основные компоненты для обработки сигналов в TCSPC.
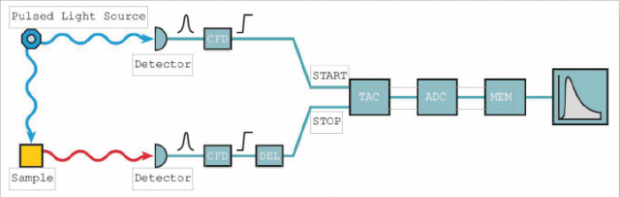
На входе электроники входящие импульсы оцениваются по высоте импульса. Только импульсы выше заданного порога будут приняты для дальнейшей обработки сигнала. Таким образом, шумовые импульсы малой амплитуды легко устраняются.
Дискриминаторы постоянной доли на входах START и STOP затем анализируют форму отдельных импульсов. Часть входящих (как правило, отрицательных) импульсов с наибольшей крутизной на переднем фронте принимается в качестве критерия временного положения. Какая часть наклона берется, будет зависеть от дроби, постоянной задержки дроби (или задержки формирования) и уровня пересечения нуля.
Порог, дробь, постоянная задержка дроби и уровень пересечения нуля будут зависеть от типа используемого детектора и должны быть согласованы с отдельным детектором.
На выходе CFD импульсы переформировываются до стандартной высоты и формы. Затем они могут быть задержаны электронной задержкой переключения. Эта задержка позже приведет к смещению всего измерения влево или вправо по оси времени.
TAC – это быстрые часы, запускаемые по сигналу START и останавливающиеся по импульсу STOP. Импульс СТАРТ инициирует нарастание пилообразного сигнала. В зависимости от времени прихода импульса СТОП рампа будет иметь меньшую или большую высоту. Как только рост рампы будет остановлен, уровень будет оставаться постоянным в течение определенного периода времени. Затем выходной импульс TAC может быть усилен, что эффективно растягивает ось времени. Минимальная и максимальная доступная (усиленная) амплитуда ТАС определяют временной диапазон.
Усиленный выходной импульс TAC фактически является аналоговым импульсом, амплитуда которого соответствует измеренному времени одной последовательности ПУСК-СТОП. Для дальнейшей обработки амплитуда импульса будет измеряться цифровым устройством измерения амплитуды импульса АЦП. Разрешение АЦП определяет, сколько дискретных значений времени возможно. Таким образом, все возможные измеренные амплитуды импульсов TAC будут помещены в разные временные интервалы. Ширина временного бина представляет собой отношение полного временного диапазона и разрешения АЦП в каналах. Это временное разрешение, обычно задаваемое в пикосекундах на канал или наносекундах на канал.
Режимы работы в TCSPC
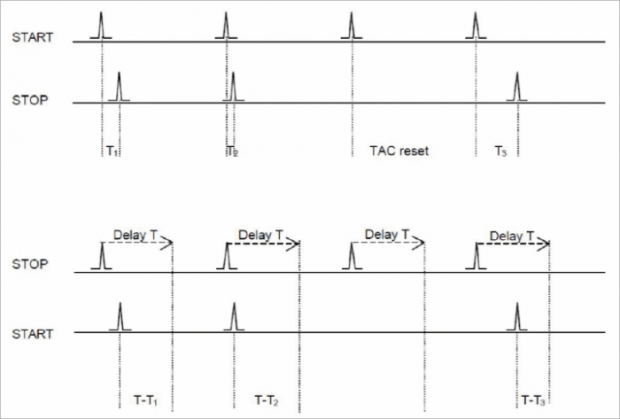
В приложениях TCSPC есть два разных режима работы: В прямом режиме частота импульсов от источника света подключается к входу START. Эта скорость (как правило, с равноотстоящими во времени импульсами) существенно выше, чем (более или менее случайные) импульсы от детектора, подключенного к входу STOP. Преимущество прямого режима состоит в том, что задержка сдвига не требуется или она относительно мала, а фотонные события с большими временами запаздывания представляются на более длинных временных шкалах, так что дополнительная инверсия временной шкалы не требуется.
Однако при высоких скоростях источника света прямой режим имеет явный недостаток. Поскольку подавляющее большинство кругов TAC запускается импульсом START, но никогда не останавливается сигналом STOP, его необходимо сбросить при переполнении. Электроника загружена более чем в 20 раз больше, чем это необходимо. Для электронных схем с верхним пределом рабочих оборотов в секунду (учитываемым мертвым временем всей системы) это означает, что самая высокая обрабатываемая скорость счета будет уменьшена более чем в 20 раз. Чтобы избежать этого (и использовать полную
возможность обработки сигналов) Электроника TCSPC может работать в обратном режиме. Здесь сигнальный кабель, несущий высокую скорость счета от источника света, подключается к входу STOP, а низкочастотный — к START. Недостатком является то, что опорные импульсы от источника света необходимо смещать с большой задержкой, чтобы они поступали на вход ТАК позже импульсов СТАРТ от детектора. Эмпирическое правило состоит в том, что эта задержка немного больше, чем шкала времени, выбранная для измерения. В реверсивном режиме временная ось гистограммы памяти внутренне перевернута, чтобы увидеть фотонные события с длительным временем запаздывания, показанные в
правой части временной оси.
Прямой (вверху) и обратный (внизу) режимы работы TCSPC
Временное разрешение и диапазон времени жизни TCSPC
TCSPC можно использовать для измерения срока службы в диапазоне от прибл. от 5 пс до более 50 мс (более 7 порядков). Нижний предел задается дрожанием электроники TCSPC, а верхний предел возникает из-за времени, которое можно позволить себе получать данные с разумной точностью.
Однако в большинстве случаев источники света и детекторы устанавливают предел для временного разрешения и измеримого диапазона времени жизни, а не метод TCSPC.
Нижний предел диапазона времени жизни (или временного разрешения, tmin) можно оценить с помощью следующего уравнения:

Сумма квадратов представляет собой оценку ширины инструментальной функции отклика (которую можно измерить, заменив флуоресцентный образец рассеивающей средой). Коэффициент 1/10 представляет собой тот факт, что при численной реконволюции время жизни, составляющее примерно 10% от ширины инструментального отклика, может быть разрешено. Часто ширина возбуждающих световых импульсов (FWHM Light Source) и ширина отклика детектора (FWHM TTSDetector) устанавливают пределы временного разрешения.
Верхний предел диапазона времени жизни будет определяться частотой следования импульсов источника возбуждающего света, но на него также будет влиять скорость темнового счета детектора. Если у флуоресценции недостаточно времени для затухания до нуля до того, как следующий импульс возбуждения попадет на образец, то будет накапливаться стационарный фоновый сигнал, что ограничивает динамический диапазон. Если позволить процессу затухания продолжаться до тех пор, пока сигнал не станет меньше 1/10000 от пикового значения, то максимальное измеримое время жизни (tmax) можно оценить следующим образом:

Проблема усложняется с детекторами с высокой скоростью темнового отсчета. Фон будет накапливаться во время сбора данных, что ограничивает динамический диапазон. Чем выше темновые отсчеты, тем менее точны измерения в длинных временных диапазонах (особенно на слабоизлучающих образцах). Мы рекомендуем максимальный темновой счет 5% от частоты источника света, например, NIR-PMT с типичным темновым счетом 50 000 имп/с следует использовать с источниками света > 1 МГц. Следовательно, максимальное время жизни должно составлять 100 нс, чтобы позволить сигналу ухудшиться до 1/10000. На практике фон будет маскировать конец распада, а это означает, что можно измерить время жизни до нескольких сотен наносекунд.
Список литературы и исследований:
1. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York, 2005
2. W. Becker, A. Bergmann, C. Biskup, Multi-Spectral Fluorescence Lifetime Imaging by TCSPC. Micr. Res. Tech. 70, 403-409 (2007)
3. W. Becker, B. Su, K. Weisshart, O. Holub, FLIM and FCS Detection in Laser-Scanning Microscopes: Increased Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811 (2011)
4. W. Becker, B. Su, A. Bergmann, K. Weisshart, O. Holub, Simultaneous Fluorescence and Phosphorescence Lifetime Imaging. Proc. SPIE 7903 (2011)
5. W. Becker, Fluorescence Lifetime Imaging - Techniques and Applications. J. Microsc. 247, 119-136 (2012)
6. W. Becker, V. Shcheslavkiy, S. Frere, I. Slutsky, Spatially Resolved Recording of Transient Fluorescence-Lifetime Effects by Line-Scanning TCSPC. Microsc. Res. Techn. 77, 216-224 (2014)
7. W. Becker, V. Shcheslavskiy, Fluorescence lifetime imaging with near-infrared dyes, Photon Lasers Med 4, 73–83, 2015
8. W. Becker, The bh TCSPC handbook. 6th edition. Becker & Hickl GmbH (2015), available on www.becker-hickl.com
9. Becker & Hickl GmbH, DCS-120 Confocal Scanning FLIM Systems, user handbook, 6th ed. (2015), available on www.becker-hickl.com
10. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 510 and LSM 710/780/880 family laser scanning microscopes. User handbook, 6th ed. (2015), available from www.becker-hickl.com
11. W. Becker (ed.), Advanced time-correlated single photon counting applications. Springer, Berlin, Heidelberg, New York (2015)
12. M.Y. Berezin, S. Achilefu, Fluorescence lifetime maesurement and biological imaging. Chem. Rev. 110, 2641-2684 (2010)
13. D.K. Bird , L. Yan , K. M. Vrotsos , K. E. Eliceiri , E. M. Vaughan. Metabolic mapping of MCF10A human breast cells via multiphoton fluorescence lifetime imaging of coenzyme NADH. Cancer Res 65:8766–8773 (2005)
14. C. Biskup, L. Kelbauskas, T. Zimmer, K. Benndorf, A. Bergmann, W. Becker, J.P. Ruppersberg, C. Stockklausner, N. Klöcker, Interaction of PSD-95 with potassium channels visualized by fluorescence lifetime-based resonance energy transfer imaging, J. Biomed. Opt. 9, 735-759 (2004)
15. L. M. Bollinger, G. E. Thomas, Measurement of the time tependence of scintillation intensity by a delayed coincidence method. Rev. .Sci. Instrum. 32, 1044-1050 (1961)
16. J. Bückers, D. Wildanger, G. Vicidomini, L. Kastrup, S.W. Hell, Simultaneous multi-lifetime multi-colour STED imaging for colocalization anlysis. Opt. Expr. 19, 3130-3143 (2011)
17. Y. Chen, A. Periasamy, Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization, Microsc. Res. Tech. 63, 72-80 (2004)
18. D. Chorvat, A. Chorvatova, Multi-wavelength fluorescence lifetime spectroscopy: a new approach to the study of endogenous fluorescence in living cells and tissues. Laser Phys. Lett. 6 175-193 (2009)
19. Diaspro A. (ed.). Confocal and two-photon microscopy: Foundations, applications and advances. Wiley-Liss (2001)
20. C. Dysli, G. Quellec, M Abegg, M. N. Menke, U. Wolf-Schnurrbusch, J. Kowal, J. Blatz, O. La Schiazza, A. B. Leichtle, S. Wolf, M. S. Zinkernagel, Quantitative Analysis of Fluorescence Lifetime Measurements of the Macula Using the Fluorescence Lifetime Imaging Ophthalmoscope in Healthy Subjects. IOVS 55, 2107-2113 (2014)
21. R.R. Duncan, A. Bergmann, M.A. Cousin, D.K. Apps, M.J. Shipston, Multi-dimensional time-correlated single-photon counting (TCSPC) fluorescence lifetime imaging microscopy (FLIM) to detect FRET in cells, J. Microsc. 215, 1-12 (2004)
22. Th. Förster, Zwischenmolekulare Energiewanderung und Fluoreszenz, Ann. Phys. (Serie 6) 2, 55-75 (1948)
23. Th. Förster, Energy migration and fluorescence. Translated by Klaus Suhling. J. Biomed. Opt. 17 011002-1 to -10
24. Jenlab GmbH, MPT Flex Multiphoton Laser Tomography. www.jenlab.de/MPTflex.114.0.html
25. M. J. Koehler, K. König, P. Elsner, R. Bückle, M. Kaatz, In vivo assessment of human skin aging by multiphoton laser scanning tomography, Opt. Lett. 31, 2879-2881 (2006)
26. M. Köllner, J. Wolfrum, How many photons are necessary for fluorescence-lifetime measurements?, Phys. Chem. Lett. 200, 199-204 (1992)
27. K. König, P.T.C. So, W.W. Mantulin, B.J. Tromberg, E. Gratton, Two-Photon excited lifetime imaging of autofluorescence in cells during UVA and NIR photostress, J. Microsc. 183, 197-204 (1996)
28. K. König, Multiphoton microscopy in life sciences, J. Microsc. 200, 83-104 (2000)
29. K. König, Clinical multiphoton tomography. J. Biophoton. 1, 13–23 (2008)
30. K. König, A. Uchugonova, Multiphoton Fluorescence Lifetime Imaging at the Dawn of Clinical Application. In: A. Periasamy, R.M. Clegg, eds., FLIM Microscopy in Biology and Medicine. CRC Press 2009
31. J.R. Lakowicz, Principles of Fluorescence Spectroscopy, 3rd edn., Springer (2006)
32. M. D. Lesoine, S. Bose, J. W. Petrich, E. A. Smith,Supercontinuum Stimulated Emission Depletion Fluorescence Lifetime Imaging. J. Phy. Chem. B, 116, 7821-7826 (2012)
33. B. R. Masters, P.T.C. So, Multi-photon excitation microscopy and confocal microscopy imaging of in vivo human skin: A comparison. Microscopy and Microanalysis 5, 282-289 (1999)
34. B.R. Masters, P.T.C. So, eds., Handbook of Biomedical Nonlinear Optical Microscopy.Oxford University Press 2008
35. M. Micic, D. Hu, Y.D. Suh, G. Newton, M. Romine, H.P. Lu, Correlated atomic force microscopy and fluorescence lifetime imaging of live bacterial cells, Colloids and Surfaces B, Biointerfaces 34, 205-212 (2004)
36. D.V. O’Connor, D. Phillips, Time-correlated single photon counting, Academic Press, London (1984)
37. J. Pawley (ed.), Handbook of biological confocal microscopy, 3rd edn., Springer (2006)
38. Periasamy, R.M. Clegg, eds., FLIM Microscopy in Biology and Medicine. CRC Press 2009
39. J.P. Philip and K. Carlsson, Theoretical investigation of the signal-to-noise ratio in fluorescence lifetime imaging, J. Opt. Soc. Am. A20, 368-379 (2003)
40. Roberts, M. S., Dancik, Y., Prow, T.W., Thorling, C.A., Li, L., Grice, J.E., Robertson, T.A., König, K., Becker,W. Non-invasive imaging of skin physiology and percutaneous penetration using fluorescence spectral and lifetime imaging with multiphoton and confocal microscopy. European Journal of Pharmaceutics and Biopharmaceutics 77, 469-488 (2011)
41. Rück, Ch. Hülshoff, I. Kinzler, W. Becker, R. Steiner, SLIM: A New Method for Molecular Imaging. Micr. Res. Tech. 70, 403-409 (2007)
42. D. Schweitzer, Metabolic Mapping. In: F.G. Holz, R.F. Spaide (eds), Medical retina, Essential in Opthalmology, Springer (2010)
43. M. C. Skala, K. M. Riching, D. K. Bird, A. Dendron-Fitzpatrick, J. Eickhoff, K. W. Eliceiri, P. J. Keely, N. Ramanujam, In vivo multiphoton fluorescence lifetime imaging of protein-bound and free nicotinamide adenine dinucleotide in normal and precancerous epithelia. J. Biomed. Opt. 12 02401-1 to 10 (2007)
44. H. Studier, W. Becker, Megapixel FLIM. Proc. SPIE 8948 (2014)

