ВЛИЯНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ КОМЫ НА ЭКСПРЕССИЮ БЕЛКА BCL-2 И КАСПАЗ 3,9 В МОЗГЕ КРЫС
© 2014г. А. В. Швецов1,2, Н.А.Дюжикова2, Ю.Н.Савенко2, Е.Г.Батоцыренова1, В.А.Кашуро1
1-лаборатория генетики высшей нервной деятельности (зав.-д.б.н. Вайдо А.И.) Федерального государственного бюджетного учреждения науки Институт физиологии им.И.П.Павлова Российской академии наук, Санкт-Петербург
2-лаборатория биохимической токсикологии и фармакологии (зав.-д.м.н. Кашуро В.А.) Федерального государственного бюджетного учреждения науки Институт токсикологии ФМБА России, Санкт-Петербург
Проведено иммуногистохимическое исследование экспрессии каспаз 3,9 и белка bcl-2 в мозге крыс в разные сроки после действия полулетальной дозы тиопентала натрия. В результате была отмечена экспрессия указанных маркеров апоптоза в сенсомоторной зоне коры и гиппокампе (зубчатая извилина и СА2 поле).
Депримирующие агенты следует рассматривать в качестве основного этиологического фактора острых отравлений, в том числе смертельных. Тиопентал натрия – препарат группы барбитуратов, широко применяемый при анестезии, а также при интенсивной терапии и коррекции внутричерепной гипертензии и фокальной ишемии, в больших дозах оказывает отравляющее воздействие и вызывает состояние комы. В ряде исследований отмечено, что поражение ЦНС нейротоксикантами сопровождается нарушениями систем жизнеобеспечения, связанными с доставкой и утилизацией кислорода, что приводит к развитию необратимых повреждений мозга [2]. Механизм действия барбитуратов основан на усилении ГАМК-опосредованного синаптического торможения и продления времени открытия хлорных каналов, что приводит к снижению скорости протекания метаболических процессов головного мозга и угнетению активности сенсомоторной зоны коры и дыхательного центра [4]. Развивающаяся при коме гипоксия усиливает токсическое специфическое действие депримирующих веществ на ЦНС, т.к. в этих условиях начинает преобладать анаэробный путь метаболизма с накоплением в ликворе молочной кислоты и развитием ацидоза, который может приводить к нарушению структуры и функции головного мозга [3].
Однако, несмотря на широкое использование во врачебной практике, некоторые аспекты цитотоксического действия тиопентала, в частности, индукция апоптоза в нервной ткани структур головного мозга, до сих пор остаются недостаточно неизученными.
Маркерами апоптоза, наиболее часто используемыми при исследовании клеточной гибели в результате действия химических веществ, фармакологических препаратов, а также ряда стрессорных факторов являются компоненты каспазного каскада - каспаза 3 и каспаза 9 и ингибирующие апоптоз белки семейства bcl-2 [1].
Целью работы явилось изучение экспрессии каспазы 3,9 и белка bcl-2 в мозге крыс в разные сроки после воздействия тиопентала натрия.
МЕТОДИКА ИССЛЕДОВАНИЯ
Объектом исследования служили белые беспородные крысы-самцы в возрасте 3-х месяцев (масса -180-220 г) в количестве 12 животных. Введение депримирующего агента (тиопентала натрия) производили внутрибрюшинно однократно в дозе LD50 за 3 суток, 1 и 2 недели до взятия биологического материала. При работе с животными соблюдались международные принципы Хельсинской декларации о гуманном отношении к животным.
Биологический материал фиксировали в 10% растворе параформальдегида при комнатной температуре. Дегидратация проводилась в изопропаноле на оборудовании Tissue-TekVIP6. Иммуногистохимическое исследование проводили на фронтальных срезах мозга (7мкм) на уровне от –2,80 мм до -4,00 мм от брегмы в соответствии со стереотаксическим атласом мозга крысы [8].
При исследовании экспрессии основных компонентов каспазного каскада использовали первичные антитела к каспазе 3 (RbpAbtoactiveCaspase 3 (Abcam)), каспазе 9 (RbmAbtoCaspase 9 (Abcam)) и bcl-2 (bcl-2 (C-21) rabbitpolyclonalIgG (SantaCruzBiotechnology)) в разведении 1:200. Вторичные антитела – универсальные биотинилированные Quick-kit (Vectastain). Визуализацию реакции с первичным антителом проводили c помощью DAB-набора (Vector).
Препараты анализировали с помощью светового микроскопа Микромед-3, совмещенного с ССDкамерой. Оценивали иммуноположительную реакцию клеток в сенсомоторной зоне коры и гиппокампе, учитывали интенсивно окрашенные клетки, отличающиеся от общего фона.
Оценка достоверности различий между группами проводилась с помощью U-критерия Манна-Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ.
На исследуемых срезах мозга развитие иммуноположительной реакции при использовании трех маркеров апоптоза обнаружили в сенсомоторной зоне коры, а также в зубчатой извилине и поле СА2 гиппокампа (рис.1).
Динамика изменения каспаз 3 и 9 в нервной ткани головного мозга после действия тиопентала натрия практически не исследована. Относительно влияния указанного депримирующего агента известно, что степень активации каспазы 3 в культуре лимфоцитов человека зависит от дозы этого вещества (Keeletal., 2005).
Результаты оценки экспрессии каспазы 9 на срезах головного мозга крыс, перенесших состояние комы после действия полулетальной дозы тиопентала натрия, представлены на рисунке 2. Через 3 суток после введения этого вещества наблюдали активацию каспазы 9 в нейронах сенсомоторной зоны коры; через 1 неделю в нейронах зубчатой извилины гиппокампа. Последующее увеличение экспрессии каспазы 9 происходило через две недели после инъекций тиопентала натрия в сенсомоторной коре, а также в СА2 поле гиппокампа.
Таким образом, воздействие тиопентала натрия в полулетальной дозе вызывает изменение содержания каспазы 9 в сенсомоторной зоне коры и гиппокампе, которая достигает наиболее высоких значений через две недели после действия этого вещества. В гиппокампе происходит последовательное изменение экспрессии каспазы 9 в разных его структурных районах, зависимое от временного интервала после окончания воздействия исследуемым депримирующим агентом.
В отличие от каспазы 9, наибольший уровень экспрессии каспазы 3 наблюдали через 3 суток после воздействия в сенсомоторной зоне коры головного мозга крыс, который снижался через две недели после инъекций тиопентала натрия, но был, тем не менее, выше, чем в контрольной группе.
В зубчатой извилине гиппокампа и СА2 иммуноположительную реакцию проявляли только единичные клетки во всех трех группах животных, что не отличалось от показателей контрольной группы.
Белок bcl-2, принадлежащий к группе ингибиторов апоптоза, подавляет апоптоз во многих тканях, включая нервную, регулирует клеточную гибель, контролируя проницаемость митохондриальной мембраны, а также ингибирует каспазы за счёт предотвращения выхода цитохрома c из митохондрий и/или за счёт связывания фактора Apaf1, активирующего апоптоз. Всl-2 наряду с каспазой 3 задействован в механизме эксайтотоксичности, вызванной каиновой кислотой, что показано на клеточных линиях гиппокампа мышей [9].
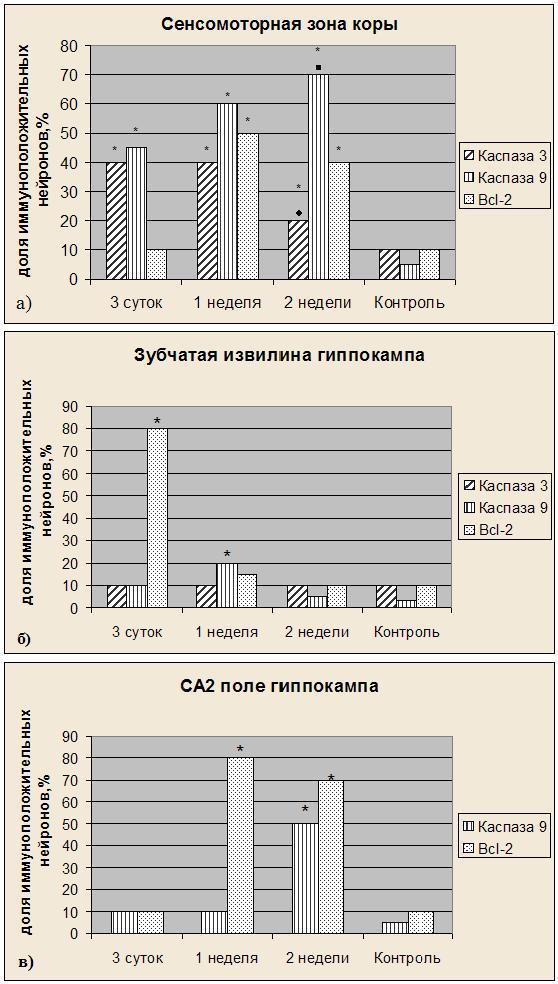
Рисунок 2. Экспрессия маркеров апоптоза в а) сенсомоторной зоне коры крыс б) зубчатой извилине гиппокампа, в) СА2 поле гиппокампа в разные сроки после инъекции тиопентала натрия.* - достоверные отличия с контрольной группой (p<0,05);? - достоверные отличия с группой «3 суток» и «1 неделя» (p<0,05); ? -достоверные отличия с группой «3 суток» (p<0,05).
Окислительный стресс изменяет экспрессию этого белка в спинном мозге [7] и гиппокампе [10] мышей. Всl-2 принимает участие в механизмах регуляции депрессивно-подобных состояний у крыс, вызванных пренатальным стрессом, что показано на клетках гиппокампа и префронтальной коры [5].
В настоящем исследовании показано, что после действия тиопентала натрия в нейронах сенсомоторной зоны коры высокая экспрессия белка bcl-2 проявляется только спустя одну неделю и сохраняется до двух недель после инъекции. В зубчатой извилине гиппокампа экспрессия белка возрастает спустя трое суток и снижается через неделю, тогда как в полях СА2 интенсивно меченые клетки появляются лишь спустя одну неделю после воздействия и сохраняются до двух недель.
Несмотря на отсутствие литературных данных о влиянии тиопентала натрия на экспрессию про- и анти-апоптотических белков в нервной ткани, нельзя не отметить, что схожими поведенческими и биохимическими эффектами воздействия, обусловленными усилением ГАМК-эргического торможения, обладает этанол, фактов о механизме цитотоксического воздействия которого накоплено гораздо больше. Показано, что острое воздействие этанола приводит к активации каспазы 3 и последующему процессу нейродегенерации в мозге 7-ми дневных крыс []. У взрослых крыс хроническое воздействие этанола сопровождается повышением в коре мозга и мозжечке уровня каспазы 3, активация которой, в свою очередь, ведет к увеличению экспрессии каспазы 9 и цитохрома с []. При этом, необходимо подчеркнуть, что содержание каспазы 3 в мозжечке оказалось значительно выше, чем в коре мозга, что позволило сделать предположение о том, что разные области мозга обладают разной чувствительностью к депрессантам.
Данные о воздействии этанола на экспрессию анти-апоптотического белка Bcl-2 данные были получены, главным образом, намоделях пренатального нарушения развития головного мозга []. На постнатальной модели было показано, что экспрессия Bcl-2 возрастает на острого воздействия этанолом после травматического поражения головного мозга [].
Таким образом, тиопентал натрия в полулетальной дозе индуцирует экспрессию маркеров апоптоза - каспазу 9, каспазу 3 и bcl-2 в нервной ткани головного мозга крыс (в сенсомоторной зоне коре и районах гиппокампа). При этом указанные области мозга демонстрируют разную чувствительность к исследуемому депрессанту, что проявляется в различных временных паттернах функциональной реализации апоптотической гибели нейронов. Следует также отметить наличие определенной связи между повышением активности ингибитора апоптоза белка bcl-2 и снижением активности каспаз.
ЛИТЕРАТУРА
- Мартынова Е.А. Регуляция активности каспаз в апоптозе // Биоорганическая химия. 2003. Т.29.№ 5. С. 518-543.
- Кашуро В.А., Долго-Сабуров В.Б., Башарин В.А., Бонитенко Е.Ю., Лапина Н.В. Неко-торые механизмы нарушения биоэнергетики и оптимизация их подходов к фармакотера-пии // Биомедицинский журнал Medline.ru. – Том 11, ст. 52. – С. 611 – 634
- Кашуро В.А., Батоцыренова Е.Г., Елаева Н.Л., Савенко Ю.Н., Лапина Н.В., Аксенов В.В. Динамика содержания нейротрофических факторов головного мозга при экспериментальной коме у крыс // Казанский медицинский журнал – 2013 – Т.94, № 5. – С. 659-699
- Calvey T, Williams N, Principles and Practice of Pharmacology for Anaesthetists.5th edition. Blackwell Publishing, 2009.
- Guan L., Jia N., Zhao X., Zhang X., Tang G., Yang L., Sun H., Wang D., Su Q., Song Q., Cai D., Cai Q., Li H., Zhu Z. The involvement of ERK/CREB/Bcl-2 in depression-like behavior in prenatally stressed offspring rats. // Brain Res Bull. 2013. V.99. P.1-8.
- Paterniti I., Impellizzeri D., Di Paola R., Esposito E., Gladman S., Yip P., Priestley J.V., Michael-Titus A.T., Cuzzocrea S. Docosahexaenoic acid attenuates the early inflammatory response following spinal cord injury in mice: in-vivo and in-vitro studies//J. Neuroinflamma-tion. 2014. V.11.№ 6. P.11-16.
- Paxinos G, Watson C. The rat brain in stereotaxic coordinates. 6th Edition. San Diego: Else-vier Academic Press.2007.456 pp.
- Ullah I. , Kim M.O. Anthocyanins Protect against Kainic Acid-induced Excitotoxicity and Apoptosis via ROS-activated AMPK Pathway in Hippocampal Neurons //CNS Neurosci. Ther. 2014. V.20. № 4 . P. 327-338.
- Von Mering M., Wellmer A., Michel U., Bunkowski S., T?ustochowska A., Brück W., Kuhnt U., Nau R. Transcriptional regulation of caspases in experimental pneumococcal meningitis //Brain Pathol. 2001. V.11.№3. Р.282-295.
Полезная информация:

